ОБЗОРНАЯ СТАТЬЯ
Полубояринов П.А., Елистратов Д.Г., Моисеева И.Я.
Микроэлемент селен обладает противопухолевой активностью. Существует взаимосвязь между возникновением рака и содержанием селена в питании человека. Последние исследования показывают необходимость увеличения потребления селена с целью профилактики и лечения онкологических заболеваний. Показаны особенности раковых клеток и возможные мишени селеновой терапии. В обзоре представлены как природные формы селена: элементный селен, селенит натрия, L-селеноцистин, L-селенометионин, L-метилселеноцистеин, так и синтетические: метилселениновая кислота, производные имидоселенокарбамата, которые обладают противоопухолевой активностью, так как являются генераторами метилселенола и селеноводорода, основными противораковыми метаболитами. Определены новые, перспективные, соединения селена: диацетофенонилселенид, 2-метилселанил-1-фенилэтанон, аминокислоты: 2-амино-3-селанилбутановая кислота, 2-амино-3-(метилселанил)бутановая кислота, которые могут обладать противоопухолевой активностью.
Ключевые слова: Селен, противоопухолевая активность, соединения селена генераторы метилселенола, селеноводорода.
Взаимосвязь между возникновением рака и содержанием селена в питании человека
Взаимосвязь между возникновением рака и содержанием селена в почве и как следствие в питании человека была впервые продемонстрирована в работе [1], а также в [2]. Экспериментальные и клинические исследования также показали, что селен обладает противоопухолевой активностью [3,4].
Эпидемиологические исследования, проведенные в 27 странах Европы, а также в США и Японии, показали существование обратной связи между уровнем потребления селена и смертностью от лейкемии, колоректального рака, рака молочной железы, яичников [5]. Также отмечается увеличение частоты развития рака предстательной, щитовидной, молочной железы, шейки матки, легкого, полости рта, пищеварительного тракта, прямой кишки при дефиците селена в организме [6-13]. В Китае, где содержание селена в почвах различных районов колеблется от недостаточного до токсичного, получены аналогичные результаты [14].
Селен, обладает эффективным профилактическим противоопухолевым действием, а его дополнительный прием снижал частоту развития опухолей более чем на 35% [15]. Клинические испытания в США показали, что у пожилых людей потребление селена, уменьшало риск развития онкологических заболеваний на 65% [16].
В эпидемиологических исследованиях, проводимых NPC (Nutritional Prevention of Cancer) в 1983-1993 г, в регионах США с низким уровнем селена в почве, с участием 1312 человек, ранее перенесших рак кожи, показали, что при употреблении 200 мкг селен (в виде дрожжей) не отмечено снижения частоты развития рака кожи, но выявлено снижение риска развития рака легкого на 48%, колоректального – на 58%, предстательной железы – на 63%, общей заболеваемости – на 37% и смертности от рака – на 50% [17]. В группе лиц, продолжавших принимать селен в течение 7,4 года, по сравнению с группой плацебо, отмечено на 52% меньше новых случаев рака предстательной железы (РПЖ), на 54% колоректального рака и на 26% рака легкого [18].
Государственная программа повышения обеспеченности населения Финляндии селеном, привела к снижению смертности от рака почти в 2 раза [19]. Также опубликованы результаты ряда эпидемиологических исследований, включавших 2000 человек с различным содержанием селена в популяциях: низким, средним и высоким. При низком уровне селена в плазме наблюдается повышение частоты развития рака не только предстательной железы, но и языка, пищевода, желудка, толстой кишки, печени, легкого, молочной, поджелудочной железы, матки, почек, мочевого пузыря, кожи, системы крови. Защитная роль высокого содержания селена в плазме крови, в профилактике рака поджелудочной железы подтверждена в ряде эпидемиологических контролируемых двойных слепых рандомизированных исследованиях [20-25].
В провинции Линьсянь, где наблюдается самая высокая в мире смертность от рака пищевода, проведены исследования с участием 3698 лиц с 1984 по 1991 г. у которых среднее содержание селена в сыворотке не превышало 73 мкг/л [26]. Использование селена по 50 мкг/сут., в виде селенизированных дрожжей, в комплексе с витамином Е и бета-каротином в течение 5,3 года привело к снижению частоты развития рака пищевода на 42% и смертности от него [27]. Исследования, проведенные на животных, показали, что ежедневное потребление селена как в неорганической, так и в органической форме, в дозах, превышающих содержание этого микроэлементов в пище, позволяют подавить рост опухолей [28-30].
Содержание селена в питании человека во многих европейских странах и РФ является относительно низким [31], из-за низких концентраций селена в почве или его плохой биодоступности для растений, в первую очередь пшеницы. Рекомендуемая суточная норма селена составляет 50 мкг для мужчин и 40 мкг для женщин в скандинавских странах [32] была основана на насыщении активности глутатионпероксидазы-3 (GSH-Px-3) в плазме. Однако, насыщение GSH-Px-3 происходит при относительно низком потреблении Se (40 мкг/день), по сравнению с потреблением селена, необходимым для насыщения GSH-Px-1 в эритроцитах (60-80 мкг / день) или GSH-Px-1 в тромбоцитах (100-110 мкг / сут). Однако, существуют признаки того, что некоторые формы рака могут быть предотвращены путем потребления селена в виде селенизированных дрожжей в дозах, превышающих требуемые для насыщения селеноферментов [33].
В России установлена норма потребности в селене в 55 мкг/сутки для женщин, 75 мкг/сутки для мужчин, 10-50 мкг/сутки для детей [34]. В США рекомендуемая норма потребления селена для взрослых составляет 55 мкг в сутки. В Великобритании, суточная норма потребления селена установлена на уровне 75 мкг для взрослых мужчин и 60 мкг для взрослых женщин [35].
Недавно было выдвинуто предположение, что потребление селена в диапазоне 40-100 мкг/сут, в первую очередь, оказывает антиоксидантное и укрепляющее иммунитет действие, в то время как потребление в диапазоне 200-500 мкг/сут обладает специфическими профилактическими свойствами против рака [36]. Однако, обеспечить потребление селена заданной величины, трудно получить из рационов питания в большинстве районов мира, где содержание селена и биодоступность в почвах умеренные или низкие.
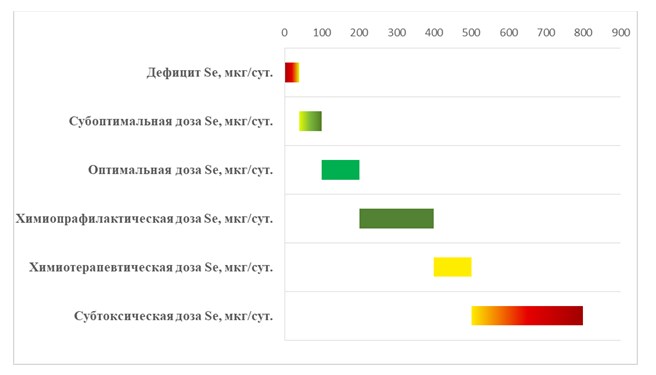
В целом, суммируя известные данные, зависимость дозы-эффекта микроэлемента селена у человека, можно представить в виде диаграммы (рис.1).
Рис.1. Схематическая диаграмма, представляющая общую зависимость доза-эффект микроэлемента селена.
Серьезный дефицит этого микроэлемента – менее 40 мкг/сут. вреден для нормального функционирования организма человека. Для поддержания физиологических функций селенопротеинов, требуется субоптимальный уровень селена – 40-100 мкг/сут. Дозировка селена, обеспечивающая оптимальную работу антиоксидантной системы и, как следствие, защиту организма от оксидативного стресса начинается от 100, а лучше, 150-200 мкг/сут. Можно предположить, что данный уровень поступления селена вполне достаточен при благоприятной экологической обстановке и низком уровне поступления проксидантов и канцерогенов, для профилактики онкологических заболеваний. Более надежные химиопрофилактические эффекты селена достигаются при концентрации 200-400 мкг/сут. и их же можно рекомендовать в сложной экологической обстановке. Таким образом, уровень поступления селена до 400 мкг/сут., условно можно обозначить антиоксидантным и он может использоваться профилактики онкологических заболеваний.
Однако, для комбинированной терапии онкологических заболеваний с использованием соединений селена, из-за биохимических особенностей раковой клетки и противоопухолевой терапии, которые будут рассмотрены ниже, следует использовать прооксидатные свойства избытка микроэлемента селена, которые начинают проявляться при более высоких дозах – не менее 400-500 мкг/сут. – химиотерапевтический уровень.
Субтоксической дозой селена, при которой не проявляются признаки отравления, даже при очень длительном поступлении микроэлемента, считается доза 800 мкг/сут.
Особенности строения клеточных стенок и окислительно-восстановительных процессов опухолевых клеток
Последние десятилетия исследований ясно показывают, что соединения селена, ингибируют рост злокачественных клеток в различных экспериментальных модельных системах. Однако ростовые, модулирующие и цитотоксические механизмы влияния соединений селена разнообразны и малоизученны. Особо следует выделить опухолевую селективность цитотоксического действия соединений селена.
Клеточные мембраны быстро делящихся клеток, а, следовательно, и раковых клеток, содержат большое количество сульфгидрильных групп (-SH) [37]. Отмечается, что экспрессия сульфгидрильных групп, наблюдаемая на мембранах раковых клеток, вызывает образование дисульфидных связей с полипептидными цепями фибриногена, что приводит к образованию высокомолекулярного полимера, сходного с фибрином, называемого парафибрином [38,39]. Разница между фибрином и парафибрином заключается в том, что последний полностью устойчив к протеолитической деградации и, следовательно, образует «оболочку» на поверхности опухолевых клеток, защищая их от разрушения фагоцитарными клетками.
Отдельные ингибиторы сульфгидрильных групп проявляют большую токсичность для некоторых видов рака животных и человека, чем для нормальных клеток, как клинически, так и в тестах на лекарственную чувствительность. Такие ингибиторы сульфгидрильных групп могут индуцировать иммунитет против рака у мышей, в отличие от других обычно используемых противоопухолевых агентов. Сканирующие электронные микрофотографии поверхности раковых клеток асцита Эрлиха, обработанных ингибиторами сульфгидрильных групп, показывают модификацию текстуры поверхности раковых клеток [40].
Блокирование сульфгидрильных групп ингибирует деление клетки [41], а раковые клетки, как активно делящиеся клетки, содержат большую концентрацию сульфгидрильных групп чем нормальные, и, следовательно, использование селенсодержащих ингибиторов сульфгидрильных групп может открыть путь к специфической терапии рака.
Другой особенностью раковых клеток, являются повышенные уровни активных форм кислорода (АФК), которые были обнаружены почти во всех злокачественных опухолях, где АФК способствуют развитию многих аспектов развития и прогрессирования опухоли [42]. В тоже время, опухолевые клетки также экспрессируют повышенные уровни антиоксидантных селенсодержащих белков, для детоксикации АФК, что свидетельствует о том, что для функционирования раковых клеток необходим тонкий баланс внутриклеточных уровней АФК. Кроме того, генерируемый радикал, место его образования, а также локальная концентрация важны для клеточных функций АФК при раке. Задачей для новых терапевтических стратегий будет точная настройка внутриклеточной передачи сигналов АФК, для эффективного отрешения клеток от событий, стимулирующих АФК-индуцированную опухоль.
Многие химиотерапевтические стратегии предназначены для чрезмерного повышения уровней АФК в клетках с целью вызвать непоправимые повреждения, которые впоследствии приводят к апоптозу опухолевых клеток [43]. В зависимости от типа опухоли, это может быть достигнуто с помощью химиотерапии или лучевой терапии [44-47]. Например, для рака поджелудочной железы на сегодняшний день доказано, что только несколько стратегий лечения являются эффективными для терапии и они включают комбинированную терапию гемцитабином с трихостатином A, эпигаллокат-3-галлатом (EGCG), капсаицином и бензилизотиоцианатом (BITC) [48-53]. Все эти препараты используют один и тот же механизм, а именно, повышают внутриклеточные уровни АФК, вызывая апоптоз [54-56]. Аминофлавон (5-амино-2-(4-амино-3-фторфенил)-6,8-дифтор-7-метилхромен-4-он;) вызывает гибель клеток в MCF-7 и MDA-MD-468 рака молочной железы, но не токсичны для незлокачественных эпителиальных клеток молочной железы MCF-10A [57,58]. После лечения аминофлавоном обнаруживается увеличение внутриклеточной АФК, что коррелирует с повышенной активацией каспазы 3 и последующим апоптозом. Ингибирование генерации АФК путем предварительной обработки клеток антиоксидантом – N-ацетил-L-цистеином (NAC) устраняет вызванную аминофлавоном гибель раковых клеток.
Антрациклины, такие как доксорубицин, даунорубицин и эпирубицин, генерируют самые высокие уровни АФК раковых клетках [59]. Координационные комплексы платины, алкилирующие агенты, камптотецины, препараты мышьяка и ингибиторы топоизомеразы (включая ингибиторы эпиподофиллотоксин-топоизомеразы II) также индуцируют высокие уровни АФК [60-62], тогда как таксаны, алкалоиды барвинка, аналоги нуклеотидов и антиметаболиты, включая антифолаты и нуклеозиды, генерируют более низкие уровни АФК [63].
Особый интерес представляют соединения селена, влияющие на окислительно-восстановительные процессы опухолевых клеток и в первую очередь генерации АФК. В современной онкологии, чаще всего используются лекарственные препараты, которые работают по узкоспециализированными молекулярным мишеням и являются унисайтовыми. Эти препараты изначально высокоэффективны, но опухолевые клетки быстро развивают к ним резистентность. Напротив, редокс-активные селеновые препараты индуцируют сложные каскады окислительно-восстановительных реакций в опухолевой клетке, которые приводят в итоге к апоптозу и являются мультисайтовыми препаратами, выработка резистентности к которым затруднена.
Редокс-активные соединения селена в высокой дозе вызывают генерацию АФК и как следствие окислительный стресс, при метаболизме в раковых клетках, многие из которых сами имеют высокий уровень АФК [64]. Таким образом, антиоксидантные защитные механизмы раковой клетки перегружены как собственной генерацией АФК, так и генерацией активных форм кислорода от редокс-активных соединений селена, что приводит к потере структурной и функциональной целостности и последующей гибели раковых клеток. Такая стратегия лечения может быть очень эффективной, особенно в сочетании с моносайтовыми лекарственными препаратами, генераторами АФК, используемыми в онкологии.
Все селеновые препараты, проявляющие противоопухолевую активность можно разделить на две группы: генераторы селеноводорода (гидроселенид-аниона HSe–) и генераторы метилселенола (CH3Se–). Оба этих окислительно-восстановительных метаболита, имеют ярко выраженные токсические свойства для раковых клеток. Следовательно, синтез и исследование имеющихся и новых селенсодержащих препаратов, обладающих противоопухолевой активностью, должен быть направлен на те молекулы, которые в процессе метаболизма в биологических средах могут генерировать селеноводород или метилселенол.
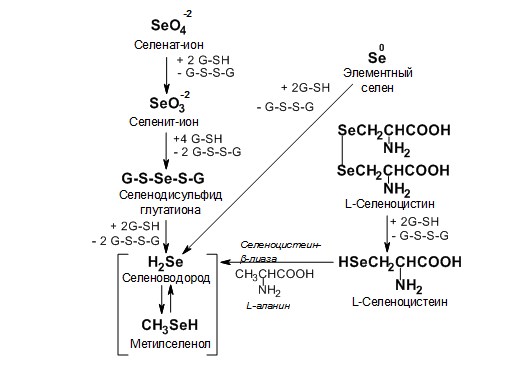
Природные генераторы селеноводорода. Природными генераторами селеноводорода являются: элементный селен (наноселен, SeNP), селенит натрия, аминокислота L-селеноцистин (схема 1).
Схема 1. Природные генераторы селеноводорода.
Селеноводород – наиболее токсичное соединение селена. В клетках присутствующий селеноводород находится в основном в виде гидроселенид-аниона (HSe–). Повреждение молекул ДНК клеток, происходит за счет активных форм кислорода которые образуются за счет его окисления [65]. Считается, что реакция окисления селеноводорода имеет сложную кинетику, которая указывает на механизм образования свободнорадикальной цепи.
8HSe– + 4O2 = Se8 + 8OH–
Предполагаемые промежуточные продукты реакции включают супероксидный анион, пероксид водорода и полиселениды [66].
Элементный (элементарный) селен. Метаболизм элементного селена с учетом его полной нерастворимости в биологических средах может проходить только гетерофазно, т.е. по сути, это прямой синтез селеноводорода из элементов. При определенных условиях тиолы, такие как восстановленный глутатион (GSH), дитиотреитол (DTT), могут восстанавливать коллоидный селен с генерацией селеноводорода [67]:
Se + 2GSH = H2Se + GS-SG
Также известно восстановление элементного селена до селеноводорода (селенида) у бактерий [68].
В исследованиях [69-72], элементный наноселен (SeNP) показал высокую противораковую активность. Противоопухолевый эффекты SeNP опосредованы их способностью ингибировать рост раковых клеток посредством индукции остановки клеточного цикла в S-фазе [73].Индукция остановки клеточного цикла на S-фазе опосредована дерегуляцией белкового комплекса [74].Клеточная мембрана играет важную роль в токсичности SeNP для раковых клеток.SeNPs изменяет биомеханические свойства раковых клеток, в частности, заметно уменьшает силу адгезии и модуль Юнга [75].
Ключевым механизмом химиопрофилактического эффекта является индукция глутатион-S-трансферазы (GST) селеном [76]. Активность GST в случае введения Nano-Se, увеличилась намного раньше и более заметно, чем в варианте с селенометионином и селенитом натрия [77]. Также SeNP частично ингибировали экспрессию циклинзависимой киназы [78].
Селенит натрия. Из двух неорганических солей только селенит натрия (Se+4), а не селенат натрия (Se+6), проявляет противоопухолевую активность. Эта разница в их биологической активности обусловлена их химическими свойствами. Cеленит (Se+4) взаимодействует, с сульфгидрильными группами белков, на поверхности опухолевых клеток и тем самым ингибирует дисульфидный обмен на поверхности мембран раковых клеток, делая его чувствительным к разрушительной активности фагоцитирующих клеток. Механизм взаимодействия селенита натрия с сульфгидрильными группами (-SH) плазматической мембраны (PM) идет по следующему уравнению [79]:
PM–[SH]2 + Se4+ → PM – S – S – PM + H2Se → Se0
Таким образом, селенит вмешивается в неферментативное образование парафибрина, который покрывает опухолевые клетки и, следовательно, делает их доступными для клеток иммунной системы организма.
Метаболизм селенита участвует в окислении GSH и производстве супероксида в биологических системах. Селенит вступает в реакцию с GSH с образованием селенодиглутатиона (GSSeSG) и глутатион дисульфида (GSSG). GSSeSG реагирует с NADPH или GSH с образованием селеноводорода (H2Se). Селенид водорода окисляется О2 с образованием элементарного селена и супероксида. Промежуточный метаболит селенотрисульфида, образующийся при взаимодействии селенита с GSH, также может продуцировать супероксид и другие АФК [80]. В одном исследовании сообщалось, что селеноцистамин (RSeSeR) может взаимодействовать с GSH с образованием восстановленного диселенида (RSe–), который взаимодействует с O2 с образованием супероксида [81], что позволяет предположить, что селеноперсульфидный анион (GSSe–), образованный из селенита, может реагировать с O2 с производить супероксид в аналогичном пути. Следовательно, супероксид, скорее всего, будет играть главную роль в прооксидантных эффектах некоторых соединений селена. Исследования показали, что различные химические формы соединений селена имеют различную эффективность в профилактике рака, а соединения селена с генерацией супероксидного аниоин, как правило, имеют лучшую противораковую активность [80-82], предполагая, что субтоксический, но прооксидантный эффект этих соединений селена, может быть механизмом с помощью которого селен вызывает ингибирование роста клеток и апоптоз.
L-Селеноцистин. L-селеноцистин также может взаимодействует с сульфгидрильными группами окисляя их:
PM–[SH]2 + (Seс)2 → PM – S – S – PM + 2Seс → H2Se → Se0
L-селеноцистин также может вмешиваться в неферментативное образование парафибрина блокируя его образование. Однако это требует дополнительных исследований.
Отмечается увеличение концентрации активных форм кислорода (АФК) у обработанных L-селеноцистином раковых клеток (MCF7 и HepG2) и разрывы ДНК, в отличие от нормальных клеток человеческих фибробластов Hs68, где увеличения АФК не наблюдалось [81].
Ингибирующее действие L-селеноцистина на пролиферацию клеток MCF-7 аденокарциномы молочной железы человека было зависимо от времени и дозы, посредством индукции остановки клеточного цикла и апоптотической гибели клеток, о чем свидетельствует активация каспазы, расщепление поли(АДФ-рибоза)полимеразы (PARP) и фрагментация ДНК [82].
L-Cеленоцистин индуцирует апоптоз клеток меланомы человека A375, путем активации АФК-опосредованного митохондриального пути и фосфорилирования p53 [83]. L-селеноцистин запускает апоптоз, зависящий от времени и дозы, в клетках меланомы человека A375, активируя пути апоптоза, опосредуемого митохондриями и рецепторами смерти. Кроме того, было обнаружено, что генерация активных форм кислорода и последующая индукция разрывов цепей ДНК, являются предшествующими медиаторами активации белка р53, индуцированного L-селеноцистином. В эксперименте с ксенотрансплантатом голых мышей L-селеноцистин значительно ингибировал рост опухоли клеток A375, посредством индукции апоптоза. Взятые вместе, эти результаты предполагают потенциальное применение L-селеноцистина в химиопрофилактике рака.
Также, набор из восьми линий раковых клеток человека чувствительныx к L-селеноцистину со значениями IC50 в диапазоне от 3,6 до 37,0 мкМ. L-селеноцистин-индуцированный дозозависимый апоптоз в клетках A375, HepG2 и MCF7 [84]. Исследования показали зависимое от времени и дозы увеличение количества внутриклеточных активных форм кислорода (АФК) в восприимчивых раковых клетках (клетки MCF7 и HepG2), обработанных L-селеноцистином. Однако индуцированное селеноцистином перепроизводство АФК не наблюдалось в невосприимчивых нормальных клетках человеческого фибробласта Hs68. Значительные разрывы цепей ДНК наблюдались в клетках MCF7 и HepG2, обработанных селеноцистином. В тоже время тиолсодержащие антиоксиданты, глутатион и N-ацетилцистеин, ингибировали образование внутриклеточных АФК, разрывы цепей ДНК, подвергшихся воздействию L-селеноцистина.
Остеосаркома представляет собой наиболее распространенную злокачественную опухоль костей у детей и подростков, которая демонстрирует сильную резистентность стандартной химиотерапии из-за высокой инвазивной способности и быстрого роста. L-селеноцистин ингибирует рост клеток остеосаркомы человека MG-63 in vitro, посредством индукции остановки S-фазы, апоптоза и активации каспаз [85]. Добавление L-селеноцистина, также приводила к дисфункции митохондрий. Кроме того, L-селеноцистин запускает фосфорилирование р53, вызывая генерацию активных форм кислорода (АФК). Важно отметить, что рост ксенотрансплантата остеосаркомы человека MG-63 у голых мышей был значительно подавлен in vivo посредством запуска апоптоза и фосфорилирования р53, что подтверждает возможность применения L-селеноцистина в лечении остеосаркомы человека. Ингибирование АФК тиолами, эффективно блокирует вызванную L-селеноцистином цитотоксичность и фосфорилирование р53.
У трех клеточных линий тройного негативного рака молочной железы (TNBC), L-селеноцистин индуцировал ингибирование роста клеток 135 [86]. Значения IC50 L-селеноцистина, составляли 40,8, 12,8 и 9,2 мкМ для клеток MDA-MB-231; 14,6, 5,4 и 3,0 мкМ для клеток MDA-MB-436; и 69,6, 29,3 и 19,9 мкМ для клеток MDA-MB-468, в течение 24, 48 и 72 часов. Изменения клеточной морфологии клеток TNBC в ответ на добавление L-селеноцистина были сходны с клетками, которые проходят апоптотический путь. Анализ клеточного цикла также показал, что L-селеноцистин также индуцировал остановку S-фазы зависимым от дозы образом.
Первичные опухоли головного мозга являются одними из наиболее распространенных причин смерти от рака. Глиомы составляют от 30% до 40% всех внутричерепных опухолей. Обычно они поражают взрослых людей среднего возраста с пиковой заболеваемостью в возрасте от 40 до 65 лет. L-селеноцистин эффективно подавляет рост клеток и индуцирует апоптоз в клетках глиомы человека, вызывая АФК-опосредованное повреждение ДНК и дисфункцию через ингибирование TrxR1 in vitro и in vivo [87]. Анализ метаболической активности клеток (МТТ-анализ) показал, что обработка L-селеноцистин значительно ингибировала жизнеспособность клеток глиомы U251 и U87. А клетки U251, подвергшиеся воздействию L-селеноцистин в течение 72 часов, демонстрировали дозозависимый апоптоз, а активация каспазы-3 дополнительно подтверждала L-селеноцистин-индуцированный апоптоз в клетках глиомы человека. В тоже время, L-селеноцистин показал меньшую цитотоксичность в отношении эндотелиальных клеток пупочной вены человека HUVEC и клеток микроглии мыши BV-2, что указывает на высокую селективность действия аминокислоты на нормальные и раковые клетки. ДНК-проточный цитометрический анализ и активность каспазы-3 показали, что обработка L-селеноцистин вызывала значительный апоптоз в клетках U251 и U87. L-селеноцистин-индуцированная фрагментация ДНК, также была обнаружена с помощью TUNEL-анализа, который дополнительно подтвердил его апоптические свойства в клетках U251. Полученные результаты свидетельствуют о том, что L-селеноцистин ингибирует рост клеток глиомы человека in vitro посредством индукции апоптоза. Кроме того, L-селеноцистин вызывает фрагментацию митохондрий клеток. Не обработанные клетки U251, имели нитевидную митохондриальную сеть с обширной взаимосвязью по всей цитоплазме. Обработка L-селеноцистин вызвала фрагментацию митохондрий от протонемы до точечной формы. Что говорит о том, что L-селеноцистин вызывает митохондриальную дисфункцию в клетках U251. L-селеноцистин индуцирует митохондриально-опосредованный апоптоз, вызывая митохондриальную дисфункцию посредством нарушения белкового баланса. Как и других исследованиях, антиоксиданты – глутатион (GSH) и N-ацетилцистеин (NAC) – ингибиторы АФК, при предварительной обработке (2 мМ GSH или NAC в течение 2 ч) клеток U251 значительно ослабляли L-селеноцистин-индуцированное ингибирование роста клеток. Добавление антиоксидантов блокировало действие L-селеноцистин-индуцированного повреждения клеток U251, активации каспазы-3, апоптоза и разрывов ДНК.
Введение per os L-селеноцистина, показало его эффективным химиотерапевтическим средством против острого лейкоза и хронического миелоидного лейкоза [88]. У пациентов, получавших L-селеноцистин снижалось количество лейкоцитов и уменьшался размер селезенки. Отмечается отсутствие острого токсического эффекта и системной хронической токсичности L-селеноцистеина при приеме 104 мг аминокислоты в сутки в течение 50 дней. Внутривенное введение селеноцистина лучше переносится, не вызывая тошноту и рвоту у пациентов.
Наши исследования также показали противоопухолевая активность L-селеноцистина, на штамме опухоли карциномы легких Льюиса (КЛЛ) [89]. Наибольшую эффективность по ингибированию перевиваемой карциномы легких Льюис, L-селеноцистин проявляет на ранних сроках роста опухоли. По всей видимости, L-селеноцистин, способен усиливать резистентность организма мышей, по отношению к перевиваемым опухолям организма и менее эффективен в стадию интенсивного развития опухоли.
Природные генераторы метилселенола.
Селеноводород в биологических средах, образующийся из селенита, элементного селена, селеноцистеина, может обратимо метилироваться с участием S-аденозилметионинаобразуя, монометилированные производные – метилселенол, монометилселенид, (CH3SeH) и мультиметилированные соединения – диметилселенид ((CH3)2Se+) и ион триметилселенония ((CH3)3Se). Противоопухолевую активность проявляет только метилселенол, тогда как диметилселенид и ион триметилселенония являются экскреторными метаболитами селена у млекопитающих [90].
Метилселенол является субстратом как для тиоредоксиновой, так и для глутаредоксиновой систем, увеличивая скорости нестехиометрических окислительно-восстановительных циклов в три раза [91]. За счет наличия метильного радикала, анион метилселенола будет обладать более выраженными нуклеофильным свойствами, чем анион селеноводорода и, следовательно, будет более реакционноспособным. Эта повышенная нуклеофильность, возможно, объясняет более высокую скорость аэробных реакций метилселенола с системами тиоредоксина и глутаредоксина, а также противоопухолевую активность.
Считается, что монометилселенол является высокоактивным противопухолевым средством, вызывающим апоптоз в раковых клетках [92]. Способ гибели клеток, вызванный этим промежуточным соединением, отличается от неметилированных видов. Метилированные виды индуцируют каспаззависимый апоптоз, тогда как неорганические формы, например селенид, вместо этого вызывают разрывы нити ДНК, фосфорилирование р53 и апоптоз, не зависящий от каспазы [93-96].
Экспериментальные данные указывают на то, что метиселенол является метаболитом селена, ответственным за химиопрофилактику рака [97]. Недавнее исследование показало, что метилселенол генерирует супероксид анион, в результате прямого восстановления как из диметилдиселенида, так и метилселениновой кислоты в присутствии GSH [98]. Метилселенол повреждает митохондрии в результате окислительного стресса и вызывает выброс цитохрома с в цитозоль, тем самым активируя каспазы и способствуя апоптозу.
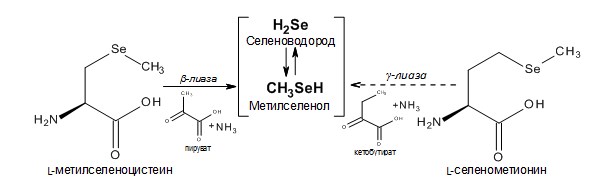
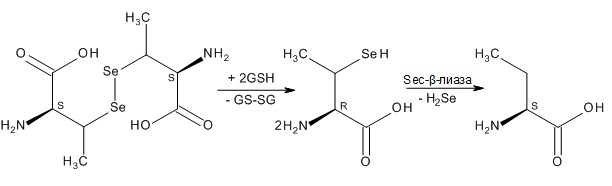
Метилселеноцистеин (MeSec, Se-метил-L-селеноцистеин) – является метильным производным аминокислоты L-селеноцистеина, но, однако, имеет метаболический путь, отличный от метаболизма L-селенометионина и L-селеноцистеина, поскольку его основным противоопухолевым метаболитом является метилселенол (CH3SeH), который образуется при расщеплении ферментом β-лиазой [99] (схема 2).
Схема 2. Аминокислоты – генераторы селеноводорода.
L-Метилселеноцистеин (MeSec) это основная форма соединения селена в обогащенном селеном чесноке, луке и брокколи [100]. В модельных опытах на опухолях молочной железы MeSec был более эффективен, чем наиболее широко изученные селеноаминокислоты [100,101]. Кроме того, MeSec ингибирует рост клеток в нескольких клеточных линиях опухоли молочной железы мыши [102,103] и клеточных линиях рака молочной железы человека [104]. Ингибирование роста клеток опосредовано индукцией апоптоза как in vitro [106], так и in vivo [107-109]. А в синхронизированной линии клеток молочной железы мыши TM6, MeSec ингибирует синтез ДНК с последующим ингибированием клеток в S-фазе [103].
MeSec является более эффективным препаратом для индукции апоптоза в клетках промиелоцитарного лейкоза человека (HL-60), чем селенит натрия [110]. Добавление 50 мкМ MeSec показала больший процент апоптоз и меньшую цитотоксичность, чем у 20 мкМ селенита натрия. При концентрации 25 мкмоль, MeSec вызывал апоптоз примерно у 40% раковых клеток. Также, MeSec увеличивал как апоптотическое расщепление поли(АДФ-рибозо)полимеразы (PARP), так и активность каспазы-3, тогда как селенит натрия – нет.
Клеточные линии молочных желез (грызунов или человека), как правило, имеют низкую β-лиазная активность. По этой причине требуется поддерживать высокий уровень (50-200 мкМ/л) L-метилселеноцистеина в биологических средах, который необходим для ингибирования роста раковых клеток. Физиологические концентрации L-метилселеноцистеина в плазме крови составляют 3-5 мкМ, а чрезмерно высокая концентрация аминокислоты может вызывать спектр неспецифических побочных эффектов [103].
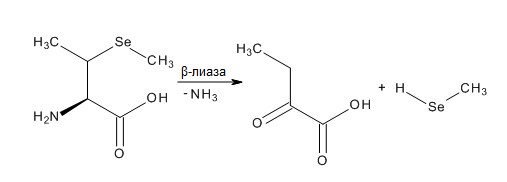
L-Селенометионин (Sem) – селеносодержащая аминокислота, является важным пищевым источником селена. Метаболизм аминокислоты селенометионина в гомогенатах печени крыс проходит через транс-сульфирующий путь в L-селеноцистеин [111], а уже L-селеноцистеин расщепляется ферментом сеноцистеин-β-лиазой в селеноводород или точнее, в гидроселенид-анион (HSe–) [112,113]. Другой путь метаболизма селенометионина заключается в его расщеплении γ-лиазой до метилселенола (MeSeH), хотя эффективность этого пути не определенна [114-116].
Как и селенит натрия, Sem обладает противоопухолевой активностью, но Sem менее эффективен, чем селенит, особенно in vitro [117,118]. Низкая противораковая активность Sem, скорее всего, связана с его метаболизмом в клетках. В исследовании показано, что неэффективные концентрации Sem в присутствии метионин-γ-лиаза (МЕТаза) индуцировали апоптоз в раковых клетках человека [119-123], что позволяет предположить, что активные метаболиты генерируются в результате катализа Sem этим ферментом. Недавнее исследование продемонстрировало, что смесь Sem и МЕТазы генерирует супероксид в системе in vitro [124]. Эти объединенные данные позволяют предположить, что супероксид может быть одним из активных метаболитов Sem, ответственных за торможение роста и апоптоз раковых клеток. Низкая активность Sem in vitro, скорее всего, связана с отсутствием или низкой активностью МЕТазы в раковых клетках. Низкая противоопухолевая активность Sem, может быть также связана с его прямым включением в белки, вместо метионина и, следовательно, отсутствует возможность его ферментативного расщепления с образованием активных метаболитов, включая супероксид, в раковых клетках.
Синтетические генераторы метилселенола.
Противоопухолевая активность природных генераторов селеноводорода и метилселенола, в виде селенсодержащих аминокислот: L-селеноцистина, L-метилселеноцистеина и особенно L-селенометионина, ограничена концентрацией ферментов (лиаз) в опухолевых клетках. Поэтому интенсивно ведется поиск органических соединений селена, лишенного данного недостатка.
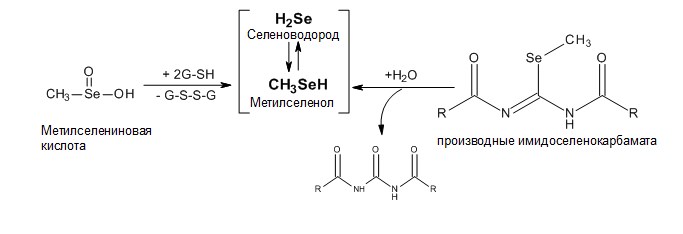
Метилселениновая кислота (MSA) – синтетический генератор метилселенола, который может восстанавливаться через неферментативные реакции с участием GSH и NADPH [125] (схема 3). Поэтому MSA является идеальным соединением для изучения противоопухолевого действия метилселенола in vitro [126].
Схема 3. Синтетические генераторы метилселенола.
Метилселениновая кислота, проявляет противоопухолевую активность, которая широко исследуется и представляет собой упрощенную версию L-метилселеноцистеина, без аминокислотного остатка, тем самым устраняя необходимость в действии β-лиазы в генерации метилселенола. Эксперименты in vitro показали, что метилселениновая кислота примерно в 10 раз более эффективна, чем L-метилселеноцистеин, в ингибировании роста клеток и индукции апоптоза в гиперпластических эпителиальных клетках молочной железы мышей и эти эффекты не были связаны с повреждением ДНК[126].
Метананлениновая кислота демонстрирует высокую эффективность ингибирования in vivo в отношении рака простаты человека по сравнению с селенометионином и селенитом натрия [127]. Недавно было сообщено, что метананлениновая кислота повышает эффективность паклитаксела для лечения тройного негативного рака молочной железы [128]. Также метанлениленовая кислота действует как ингибитор ароматазы, что может быть использовано в терапии рака молочной железы, чувствительного к рецепторам эстрогена, у женщин в постменопаузе [129] и демонстрирует перспективность в качестве сенсибилизирующего агента для апоптоза, в нескольких линиях рака [130]. А также ограничивает рост опухоли метастатического рака молочной железы [131] и рак легких Льюиса у мышей. [132].
Перспективными противоопухолевыми препаратами являются производные имидоселенокарбамата, которые генерируют метилселенол путем гидролиза. Кинетика высвобождения метилселенола, этими молекулами, сильно зависит от природы радикалов и коррелируют с их ранней проапоптотической активностью [133]. С этой точки зрения, производные имидоселенокарбамата, предоставляют интерес для рациональной разработки новых препаратов, которые выделяют метилселенол и имеют изученный путь метаболизма.
Некоторые производные имидоселенокарбамата эффективно подавляют экспрессию фактора роста эндотелия сосудов, индуцированного гипоксией, в опухолевых клетках NCI-H157. Более того, эти молекулы продемонстрировали интересные проапоптотические и антипролиферативные эффекты.
Хинолин имидоселенокарбамат [134] (EI201), ингибирует злокачественное прогрессирование, при различных видах рака, вызывая in vitro, вызывая аутофагию и апоптоз. А также способствует потере поддержания самообновления и онкогенной способности раковых стволовых клеток и вызвал уменьшение размера и количества опухолевых сфер в клетках PC-3, HT-29 и MCF-7. При более высокой концентрации вызвал элиминацию почти всех опухолевых сфер в трех исследованных клеточных линиях. Кроме того, EI201 подавлял рост опухоли простаты почти на 80% in vivo по сравнению с контрольной группой при относительно низкой дозе в мышиной модели ксенотрансплантата.
Селенсодержащие ксенобиотики, не элиминирующие селен в биологических средах.
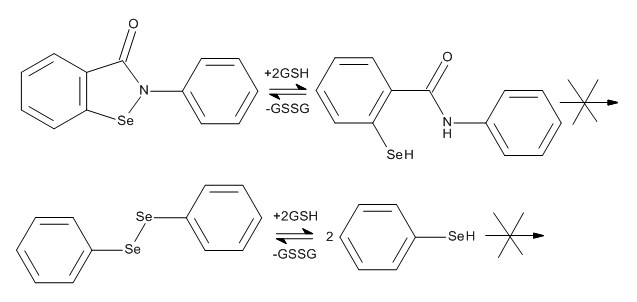
Существует ряд селенсодержащих соединений – антиоксидантов – миметиков глутатионпероксидазы: эбселен (2-фенилбензоселеназол-1,2-3(2н)-он) и дифенилдиселенид [135](схема 4). Однако, они не являются источниками биодоступного селена, так как не взаимодействуют с тиолами, как селенит натрия, не расщепляются ферментами, как селенсодержащие аминокислоты и не подвергается гидролизу, с образованием, селеноводорода и метилселенола. Т.е. у них отсутствуют механизмы элиминирования атома селена из молекулы соединения и последующей утилизации в виде метаболитов в биологических средах.
Эбселен не является биодоступным источником селена [136], а жировых тканях он присутствует в виде метаболитов, которые при действии GSH легко восстанавливаются до исходного эбселена [137].
Схема 4. Антиоксидантная активность эблелена и дифенилдиселенида.
В исследовании [138,139] эбселен индуцировал апоптоз клеток множественной меланомы, опосредованной увеличением концентрации АФК и усиливал гибель клеток глиомы С6 в условиях кислородной и глюкозной депривации [140,141]. Отмечается активность в ингибировании раковых клеток простаты PNT1A. Дифенилдиселенид и его производные также проявляли противоопухолевую активность в отношении клеток рака легких DPDS [142]. А нанокапсулированный дифенилдиселенид снижал жизнеспособность клеток глиомы С6 [143].
На наш взгляд, противоопухолевую активность у ксенобиотиков, которые не генерируют селеноводород и метилселенол, обусловлена только взаимодействием с сульфгидрильными группами клеточной мембраны клеток и ферментов.
Новые генераторы селеноводорода и метилселенола.
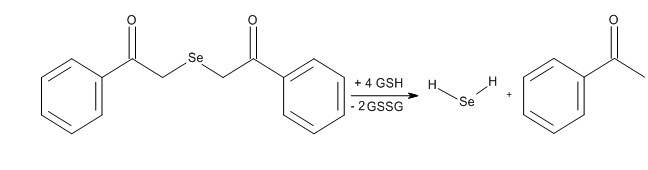
Наши исследования показали, что к новым генераторам селеноводорода, с потенциальными противопухолевыми свойствами можно отнести селенсодержащий ксенобиотик диацетофенонилселенид (ДАФС-25, 1,5-дифенил-3-селенапентадион-1,5) [144]. В наших исследованиях [145,146] нами показано, что диацетофенонилселенид взаимодействует с восстановленным глутатионом, цистеином с образованием элементного селена и ацетофенона (идентифицирован методом ГЖХ). Предложена схема новой качественной реакции на цистеин, восстановленный глутатион и диацетофенонилселенида (схема5).
Схема 5. Реакция диацетофенонилселенида с восстановленным глутатионом.
Методом ВЭЖХ, была подтверждена реакции диацетофенонилселенида с восстановленным глутатионом с образованием селеноводорода и ацетофенона [147]. Реакция диацетофенонилселенида с восстановленным глутатионом, проводимая в атмосфере аргона, c последующим барботированием газа через фосфатный буфер (pH..8) c реактивом Эллмана, вызывала изменение окраски до ярко-желтой, что подтверждает выделение селеноводорода в ходе реакции.
Реакция диацетофенонилселенида с тиолами клетки, также приводит к образованию селеноводорода и ацетофенона [145]. Выделяющийся в результате реакции ацетофенон малотоксичен, (LD50 815 мг/кг, per os, крысы) [148] и использовался ранее в медицине, как снотворное и противосудорожное средство. Достоинством диацетофенонилселенида является его липофильность, а как следствие – способность проникать через клеточные стенки. Образовавшийся при окислении селеноводорода – элементный селен также может служить нетоксичным депо этого микроэлемента. Таким образом, диацетофенонилселенид, является генератором селеноводорода и, возможно, перспективным противоопухолевым препаратом.
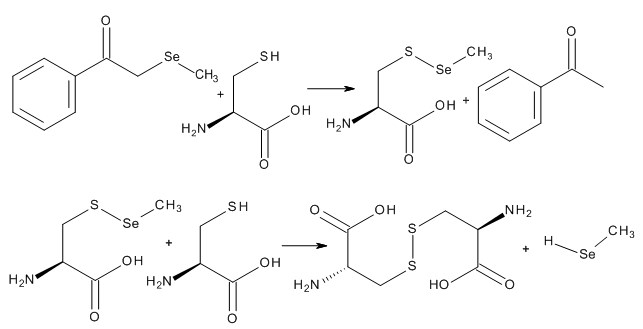
Изучив механизм реакции диацетофенонилселенида с тиолами клетки, нам представлялось целесообразным, синтезировать и изучить подобный генератор, но уже метилселенола, наиболее эффективного противопухолевого метаболита селеновых эфиров. Таким селенорганическим препаратом является 2-метилселанил-1-фенилэтанон.
По аналогии с реакцией диацетофенонилселенида с тиолами нами была предложена схема реакции 2-метилселанил-1-фенилэтанона с цистеином, где на первом этапе образуются полупродукты ацетофенон и 2-амино-3-метилселенилсульфанилпропановая кислота (схема 6).
Схема 6. Реакция 2-метилселанил-1-фенилэтанона с цистеином.
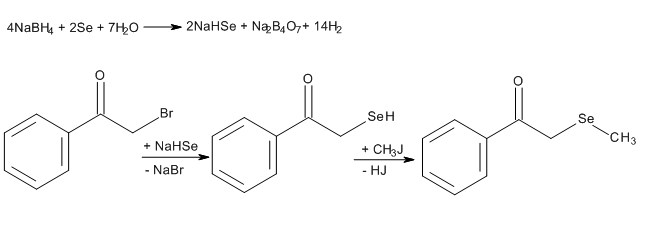
Следующим этапом является образование L-цистина и метилселенола. Следует отметить что, данная реакция препятствует синтезу 2-метилселанил-1-фенилэтанона из фенацилбромида, селенида натрия и йодметана, о чем свидетельствует образование большого количества ацетофенона в реакционной смеси (схема 7).
Схема 7. Синтез 2-метилселанил-1-фенилэтанона.
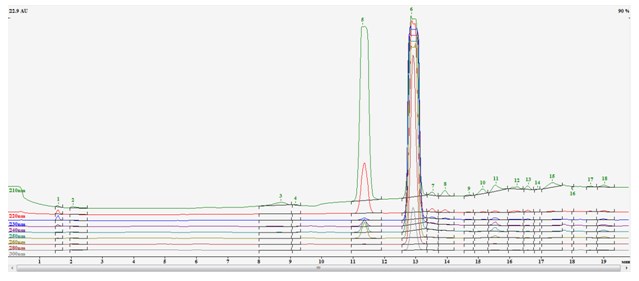
Анализ эфирного экстракта продуктов реакции, методом ВЭЖХ, показал наличие большого количества ацетофенона (рис.2).
Рис.2. Хроматограмма продуктов реакции фенацилбромида, селенида натрия и йодметана: 1- пик 2-метилселанил-1-фенилэтанон, 2-ацетофенон.
По всей видимости, селенол, образующийся в результате реакции, вступает в побочную реакцию с целевым продуктом реакции – 2-метилселанил-1-фенилэтаноном с образованием ацетофенона.
Реакция эфирного экстракта рекционной смеси, содержащая-метилселанил-1-фенилэтанон с избытком цистеина, проводимая в атмосфере аргона, c последующим барботированием газа через фосфатный буфер (pH..8) c реактивом Эллмана, вызывала изменение окраски до ярко-желтой, что подтверждает выделение метилселенола в ходе реакции (схема).
К новому генератору селеноводорода, также можно отнести синтезированное нами новое 3,3’-диметилпроизводное L-селеноцистина – аминокислоту 3,3’-диметил-L-селеноцистин [149]. Показано, что селен из 3,3’-диметил-L-селеноцистина, также, как и из природной аминокислоты – L-селеноцистина аккумулируется в тканях печени, мышцах и сыворотке крови крыс. Можно предположить, что 3,3’-диметил-L-селеноцистин также восстанавливается до 2-амино-3-селанилбутановой кислоты восстановленным глутатионом, а затем расщепляется ферментом селеноцистеин-β-лиазой (КФ 4.4.1.16) до селеноводорода и α-аминомасляной кислоты (AABA, бутирин) – предшественника синтеза офтальмовой кислоты, являющейся аналогом глутатиона в хрусталике глаза (схема 8).
Схема 8. Возможный путь метаболизма 3,3-диметил-L-селеноцистина.
Таким образом, если предложенный механизм метаболизма аминокислоты подтвердится в дальнейших исследованиях, то 3,3’-диметил-L-селеноцистин, как и L-селеноцистин будет генератором селеноводорода.
Также, на основе известного синтеза, нами была получена 2-амино-3-(метилселанил)бутановая кислота – новое метилированое производное 3,3’-диметил-L-селеноцистина [150](схема 9).
Схема 9. Возможный путь метаболизма 3,3-диметил-L-селеноцистина.
Можно предположить, что 2-амино-3-(метилселанил)бутановая кислота, как и L-метилселеноцистеин также под воздействием β-лиазы, будет отщеплять метилселенол, с образованием кетобутирата.
Таким образом, на наш взгляд, при исследовании противопухолевой активности соединений селена, должны учитываться следующие важные особенности:
- соединение селена должно обладать физиологической совместимостью и способностью метаболизироваться в биологических средах;
- выраженной противоопухолевой активностью обладают молекулы селенсодержащих соединении, способные генерировать метилселенол или селеноводород в биологических средах;
- выбор дозы должен учитывать особенности как опухолевых клеток (высокие уровень АФК), так и прооксидантную активность, способствующую генерации АФК, высоких доз селена.
Литература
- Schrauzer G.N. Selenium and cancer: A review. Bioinorg. Chem. 1976;5: 275–281.
- Rayman M.P. Selenium and human health. Lancet. 2012; 379:1256–1268.
- Ip C., Hayes C., Budnick M., Ganther H.E. Chemical form of selenium critical metabolites, and cancer prevention. Cancer Res. 1991;51:595–600.
- Frenkel G.D., Falvey D., MacVicar C. Products of the reaction of selenite with intracellular sulhydryl groups. Biol. Trace Elem. Res. 1991;30:9–18.
- 13./ Schrauzer G. N., White D. A., Schneider C. J. Cancer mortality correlation studies. III. Statistical association with dietary selenium in- takes // Bioinorg. Chem. — 1977. — Vol. 7, N 1. — P. 23—31.
- Association between serum selenium and the risk of cancer / Sa- lonen J. T., Alfthan G., Huttunen J. K., Puska P. // Am. J. Epidemiol. — 1984. — Vol. 120, N 3. — P. 342—349.
- Combs G., Combs S. The role of selenium in nutrition. — New York: Acad. Press, 1986. Vol. 38. P. 179-199.
- Plasma selenium levels and the risk of colorectal adenomas / Rus- so M. W., Murray S. C., Wurzelmann J. I., Woosley J. T., Sandler R. S. // Nutrition Cancer. — 1997. — Vol. 28, N 2. — P. 125—129.
- Is low selenium status a risk factor for lung cancer? / Knekt P., Marniemi J., Teppo L., Heliövaara M., Aromaa A. // Am. J. Epidemiol. — 1998. — Vol. 148, N 10. — P. 975—82.
- Young K. J., Lee P. N. Intervention studies on cancer // Eur. J. Cancer Prevent. — 1999. — Vol. 8, N 2. — P. 91—103.
- Blood serum selenium in the province of Mérida, Venezuela, re- lated to sex, cancer incidence and soil selenium content / Burguera J. L.,Burguera M., Gallignani M., Alarcon O. M., Burguera J. A. // J. Trace El- ement Electrolyt Health Dis. 1990. Vol. 4, N 2. P. 73-77.
- Correlation of cervical cancer mortality with reproductive and dietary factors, and serum markers in China / Guo W.-D., Hsing A. W., Li J.-Y., Chen J.-S., Chow W.-H., Blot W. J. // Intern. J. Epidemiol. 1994. Vol. 23. P. 1127-1132.
- Prediagnostic serum selenium in a case-control study of thy- roid cancer / Glattre E., Thomassen Y., Thoresen S., Haldorsen T., Lund- Larsen P. G., Theodorsen L., Aaseth J. // Int. J. Epidemiol. — 1989. — Vol. 18. — P. 45—49.
- Regional variation of cancer mortality incidence and its rela- tion to selenium levels in China / Yu S. Y., Chu Y. J., Gong X. L., Hou C., Li W. G., Gong H. M., Xie J. R. // Biol. Trace Elem. Res. 1985. Vol. 7. P. 21-29.
- Combs G. F. Jr., Gray W. P. Chemopreventive agents: selenium // Pharmacol. Ther. 1998. Vol. 79. P. 179-192.
- Regional variation of cancer mortality incidence and its rela- tion to selenium levels in China / Yu S. Y., Chu Y. J., Gong X. L., Hou C., Li W. G., Gong H. M., Xie J. R. // Biol. Trace Elem. Res. 1985. Vol. 7. P. 21-29.
- Cancer mortality correlation studies. III. Statistical association with dietary selenium intakes / Schrauser G. N., Wbite D. A., Schnei- der C. J. // Bioorg. Chem. 1977. Vol. 7. P. 23.
- Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group / Clark L. C., Combs G. F. Jr., Turnbull B. W., Slate E. H., Chalker D. K., Chow J., Davis L. S., Glover R. A., Graham G. F., GАФКs E. G., Krongrad A., Lesher J. L. Jr., Park H. K., Sanders B. B. Jr., Smith C. L., Taylor J. R. // JAMA. 1996. Vol. 276. P. 1957-1963.
- Combs G. F., Lu J. Selenium as a cancer preventive agent // Selenium: Its molecular biology and role in human health / Hatfield D., Ber- ry M., Gladyshev V. (eds.) — 2nd ed. — New York: Springer, 2006. — P. 249—264.
- Aro A., Alfthan G. Effects of supplementation of fertilizers on human selenium status in Finland // Analyst. 1995. Vol. 120. P. 841-843.
- Whanger P. D. Selenium and its relationship to cancer: an update dagger // Br. J. Nutr. 2004. Vol. 91.P. 11-28.
- Rayman M. P., Combs G. F. Jr., Waters D. J. Selenium and vitamin E supplementation for cancer prevention // JAMA. — 2009. — Vol. 301, N 18. — P. 1876.
- Plasma selenium level before diagnosis and the risk of pАФКtate cancer development / Brooks J. D., Metter E. J., Chan D. W., Sokoll L. J., Landis P., Nelson W. G., Muller D., Andres R., Carter H. B. // J. Urol. — 2001. — Vol. 166, N 6. — P. 2034—2038.
- Toenail selenium levels and the subsequent risk of pАФКtate cancer: a pАФКpective cohort study / Van den Brandt P. A., Zeegers M. P., Bode P., Goldbohm R. A. // Cancer Epidemiol. Biomarkers Prev. — 2003. — Vol. 12. — P. 866—871.
- Taylor P. R., Parnes H. L., Lippman S. M. Science Peels the Onion of Selenium Effects on PАФКtate Carcinogenesis // J. Natl. Cancer Inst. — 2004. — Vol. 96, N 9. — P. 645—647.
- A pАФКpective study of plasma selenium levels and pАФКtate cancer risk / Li H., Stampfer M. J., Giovannucci E. L., Morris J. S., Wil- lett W. C., Gaziano J. M., Ma J. // J. Natl. Cancer Inst. — 2004. — Vol. 96, N 9. — P. 696—703.
- Abnet C. C., Qiao Y. L., Dawsey S. M. PАФКpective study of serum retinol, beta-carotene, beta-cryptoxanthin, and lutein/zeaxanthin and esophageal and gastric cancers in China // Cancer Causes Control. — 2003. — Vol. 14, N 7. — P. 645—655.
- Prevention of esophageal cancer: the nutrition intervention trials in Linxian, China / Taylor P. R., Li B., Dawsey S. M., Li J.-Y., Yan C. S., Guo W. D., Blot W. J., Weng W., Liu B. Q., Zheng S. F., Yang Q., Yu Y., Sun Y., Li G. Y., Liu S. F. // Cancer Res. 1994. Vol. 54. P. 2029-2031.
- Hatfield D. L., Berry M. J., Gladyshev V. N. Selenium: Its Molecular Biology and Role in Human Health. Springer Science + Business Media, LLC, New York, 2006. 420 р.
- Reeves M. A., Hoffmann P. R. The human selenoproteome: recent insights into functions and regulation // Cell Mol. Life Sci. — 2009.— Vol. 66, N 15.— P. 2457—2478.
- Both selenoproteins and low molecular weight selenocompounds reduce colon cancer risk in mice with genetically impaired selenoprotein expression / Irons R., Carlson B. A, Hatfield D. L., Davis C. D. // J. Nutr. — 2006. — Vol. 136. — P. 1311—1317.
- Rayman M. P. The importance of selenium to human health // Lancet. — 2000. — Vol. 356. — P. 233—241.
- Schrauser G. Selen zur Prevention und Therapie von Krebser- krankungen // Biol. Med. — 2004. — Vol. 3. — P. 167—170.
- Serum selenium concentration at diagnosis and outcome in patients with haematological malignancies / Stevens J., Waters R., Sieniawska C., Kassam S., Montoto S., Fitzgibbon J., Rohatiner A., Lister A., Joel S. // Br. J. Haematol. — 2011. — Vol. 154. — P. 448—456.
- Методические рекомендации 2.3.1.2432-08. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. doc Архивная копия от 19 февраля 2016 на Wayback Machine. 4.2.2.2.2.6. Селен
- Papp, Laura Vanda; Lu, Jun; Holmgren, Arne; Khanna, Kum Kum (2007). «From Selenium to Selenoproteins: Synthesis, Identity, and Their Role in Human Health». Antioxidants & Redox Signaling 9 (7): 775—806
- Clark LC, Combs GF, Jr, Turnbull BW, Slate EH, Chalker DK, Chow J, et al. Effects of selenium supplementation for patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group. Jama. 1996; 276 : 1957–63.
- 38. Rayman MP. The argument for increasing selenium intake. Proc Nutr Soc. 2002; 61 : 203–215.
- Lipinski B., Pretorius E. Iron-induced fibrin in cardiovascular disease. Curr. Neurovasc. Res. 2013; 10 : 269-274.
- Lipinski B., Pretorius E. Novel pathway of iron-induced blood coagulation: Implications for diabetes mellitus and its complications. Pol. Arch. Med. Wewn. 2012; 122 : 115–122.
- Frenkel GD, Falvey D., MacVicar C. Products of the reaction of selenite with intracellular sulhydryl groups. Biol. Trace Elem. Res. 1991; 30 : 9–18.
- Frances E. Knock, Protein-Sulfhydryl Groups in Cancer and Gene Control. JAMA. 1966;197(2):151.
- Knock F, Galt R, Oester Y, Sylvester R, Rebechini-Zasadny H. Selected sulfhydryl inhibitors capable of inducing immunity against cancer in mice. Oncology. 1979;36(5):197-201.
- Trachootham D, Alexandre J, Huang P. Targeting cancer cells by a radical therapeutic approach? Nat Rev Drug Discov. 2009; 8 (7): 579–91.
- Storz P. Reactive oxygen species in tumor progression. Front Biosci. 2005; 10 : 1881–96.
- 4 Alexandre J, et al. Accumulation of paclitaxel-induced cancer cell death in vitro and in vivo. Int J Cancer. 2006; 119 (1): 41–8.
- 4 Bairati I, et al. It has been shown that patients may have been subject to a trial. J Clin Oncol. 2005; 23 (24): 5805-13.
- 4 Llobet D, et al. Antioxidants block proteasome inhibitor function in endometrial carcinoma cells. Anticancer Drugs. 2008; 19 (2): 115–24.
- 4 Zhang R, et al. In vitro and in vivo induction of apoptosis by capsaicin in vitro cancer cells mediated through АФК generation and mitochondrial death pathway. Apoptosis. 2008; 13 (12): 1465–78.
- 5 Gahr S, et al. The combination of the histone-deacetylase inhibitor trichostatin A and the gemcitabine induces inhibition of proliferation in pancreatic carcinoma cells. Int j oncol. 2007; 31 (3): 567–76.
- 51. Lee KH, et al. Epigenetic silencing of MicroRNA miR-107 regulates cyclin-dependent kinase 6 expression in pancreatic cancer. Pancreatology. 2009; 9 (3): 293–301.
- 5 Shankar S, et al. EGCG inhibits growth, invasion, angiogenesis and metastasis of pancreatic cancer. Front Biosci. 2008; 13 : 440–52.
- Shankar S, Suthakar G, Srivastava RK. Epigallocatechin-3-gallate inhibits cell cycle and induces apoptosis in pancreatic cancer. Front Biosci. 2007; 12 : 5039–51.
- 5 Srivastava SK, Singh SV. Cell cycle arrest, apoptosis, induction and inhibition of benzyl isothiocyanate against pancreatic cancer cells. Carcinogenesis. 2004; 25 (9): 1701–9.
- 5 Qanungo S, et al. Epigallocatechin-3-gallate induces mitochondrial membrane depolarization and caspase-dependent apoptosis in pancreatic cancer cells. Carcinogenesis. 2005; 26 (5): 958–67.
- Donadelli M, et al. Synergistic inhibition of pancreatic adenocarcinoma cell growth by trichostatin A and gemcitabine. Biochim Biophys Acta. 2007; 1773 (7): 1095–106.
- 5 Sahu RP, et al. It leads to a reduction in the risk of cell death. Carcinogenesis. 2009
- 5 Loaiza-Perez AI, et al. Aryl hydrocarbon receptor of antitumor aminoflavone: basis of selective toxicity for MCF-7 breast tumor cells. Mol Cancer Ther. 2004; 3 (6): 715-25.
- 5 McLean L, et al. Aminoflavone induces damage and reactive oxidative species-mediated apoptosis in breast cancer cells. Int J Cancer. 2008; 122 (7): 1665–74.
- Mizutani H, Tada-Oikawa S, Hiraku Y, Kojima M, Kawanishi S. Mechanism of apoptosis induced by doxorubicin through the generation of hydrogen peroxide. Life Sci. 2005; 76 : 1439–1453.
- Wang H, Li X, Chen T, Wang W, Liu Q, Li H, Yi J, Wang J. Mechanisms of verapamil-enhanced chemosensitivity of the gallbladder and MRP1 downregulation. Oncol Rep. 2013; 29 : 676–684.
- Li XX, Dong Y, Wang W, Wang HL, Chen YY, Shi GY, Yi J, Wang J. Emodin as the effective agent in targeting. Stem Cells Dev. 2013; 22 : 554–566.
- Li XX, Wang HL, Wang J, Chen YY, Yin XB, Shi GY, Li H, Hu ZQ, Liang XW. Emodin enhances cisplatin-induced cytotoxicity in human bladder cells through АФК elevation and MRP1 downregulation. BMC Cancer. 2016; 16 : 578.
- 6 Conklin KA. Chemotherapy-associated oxidative stress: impact on chemotherapeutic effectiveness. Integr Cancer Ther. 2004; 3 : 294–300. doi: 10.1177 / 1534735404270335. [ PubMed ] [ CАФКsRef ] [ Google Scholar ]
- K Charalabopoulos,1, A Kotsalos,1 A Batistatou, A Charalabopoulos, P Vezyraki,1 D Peschos,2 V Kalfakakou,1 and A Evangelou1Selenium in serum and neoplastic tissue in breast cancer: correlation with CEA. Br J Cancer. 2006 Sep 18; 95(6): 674–676.
- Seema Kumari, Anil Kumar Badana, Murali Mohan G, Shailender G, and RamaRao MallaReactive Oxygen Species: A Key Constituent in Cancer Survival. Biomark Insights. 2018; 13:
Генераторы селеноводорода.
- Peyroche G., Saveanu C., Dauplais M., Lazard M., Beuneu F., Decourty L., Malabat C., Jacquier A., Blanquet S., Plateau P. Sodium Selenide Toxicity Is Mediated by O2-Dependent DNA Breaks // PLoS ONE. 2012. V. 7. № 5. P. 1–10.
- Nuttall K.L., Allen F.S. Kinetics of the reaction between hydrogen selenide ion and oxygen // Inorg Chim Acta. 1984. № 91. P. 243–246.
- Nuttall K.L., Fritz S.A. Hydrogen selenide ion and colloidal selenium in the catalytic oxidation of thiols // Inorganica Chimica Acta. 1984. V. 93. № 2. P. 85–88.
- Herbel M.J., Blum J.S., Oremland R.S., Borglin S.E. Reduction of elemental selenium to selenide: Experiments with anoxic sediments and bacteria that respire Se-oxyanions // Geomicrobiology Journal. 2003. P.587–602
- Ramamurthy CH, Sampath KS, Arunkumar P, et al. Green synthesis and characterization of selenium nanoparticles and its augmented cytotoxicity with doxorubicin on cancer cells. Bioprocess Biosyst Eng. 2013;36(8):1131–1139.
- 72. Liao W, Yu Z, Lin Z, et al. Biofunctionalization of selenium nanoparticle with Dictyophora indusiata polysaccharide and its antiproliferative activity through death-receptor and mitochondria-mediated apoptotic pathways. Sci Rep. 2015;5:18629.
- Liao W, Zhang R, Dong C, Yu Z, Ren J. Novel walnut peptide-selenium hybrids with enhanced anticancer synergism: facile synthesis and mechanistic investigation of anticancer activity. Int J Nanomedicine. 2016;11:1305–1321.
- Yanhua W, Hao H, Li Y, Zhang S. Selenium-substituted hydroxyapatite nanoparticles and their in vivo antitumor effect on hepatocellular carcinoma. Colloids Surf B Biointerfaces. 2016;140:297–306.
- Luo H, Wang F, Bai Y, Chen T, Zheng W. Selenium nanoparticles inhibit the growth of HeLa and MDA-MB-231 cells through induction of S phase arrest. Colloids Surf B Biointerfaces. 2012;94:304–308.
- Lopez-Heras I, Sanchez-Diaz R, Anunciação DS, Madrid Y, Luque-Garcia JL, Camara C. Effect of chitosan-stabilized selenium nanoparticles on cell cycle arrest and invasiveness in hepatocarcinoma cells revealed by quantitative proteomics. J Nanosci Nanotechnol. 2014;5(5):1.
- Pi J, Yang F, Jin H, et al. Selenium nanoparticles induced membrane bio-mechanical property changes in MCF-7 cells by disturbing membrane molecules and F-actin. Bioorg Med Chem Lett. 2013;23(23):6296–6303.
- Wang H, Zhang J, Yu H. Elemental selenium at nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes: comparison with selenomethionine in mice. Free Radic Biol Med. 2007;42(10):1524–1533.
- Li H, Zhang J, Wang T, Luo W, Zhou Q, Jiang G. Elemental selenium particles at nano-size (Nano-Se) are more toxic to Medaka (Oryzias latipes) as a consequence of hyper-accumulation of selenium: a comparison with sodium selenite. Aquat Toxicol. 2008;89(4):251–256.
- Estevez H, Garcia-Lidon JC, Luque-Garcia JL, Camara C. Effects of chitosan-stabilized selenium nanoparticles on cell proliferation, apoptosis and cell cycle pattern in HepG2 cells: comparison with other selenospecies. Colloids Surf B Biointerfaces. 2014;122:184–193.
- Lipinski B. Sodium Selenite as an Anticancer Agent. Anticancer Agents Med Chem. 2017; 17 (5): 658-661.
- 82. Spallholz JE. Selenium toxicity and carcinostatic activity. Free Radic Biol Med. 1994; 17 : 45–64. [ PubMed ] [ Google Scholar ]
- Chaudiere J, Courtin O, Leclaire J. Glutathione oxidase activity of selenocystamine: a mechanistic study. Arch Biochem Biophys. 1992; 296 : 328–36.
- Spallholz JE, Palace VP, Reid TW. Methioninase and selenomethionine but not Semethylselenocysteine generate methyl chemical and superoxide in vitro chemiluminescent assay: implications for the nutritionalcarcinostatic activity of selenoamino acids. Biochem Pharmacol. 2004; 67 : 547–54.
Селеноцистин.
- Chen T., Wong Y.S. Selenocystine induces S-phase arrest and apoptosis in human breast adenocarcinoma MCF-7 cells by modulating ERK and Akt phosphorylation. J. Agric Food Chem. 2008 Vol. 56(22)-P.10574-10581.
- Chen T., Wong Y.S. Selenocystine induces apoptosis of A375 human melanoma cells by activating АФК-mediated mitochondrial pathway and p53 phosphorylation. Cell Mol Life Sci. 2008 Sep; 65(17). pp. 2763-75.
- Chen T., Wong Y.S. Selenocystine induces reactive oxygen species-mediated apoptosis in human cancer cells. Biomed Pharmacother. 2009 Feb. V.63(2). pp.105-113.
- Wang W, Meng FB, Wang ZX, Li X, Zhou DS. Selenocysteine inhibits human osteosarcoma cells growth through triggering mitochondrial dysfunction and АФК-mediated p53 phosphorylation. Cell Biol Int. 2018 May;42(5):580-588.
- Long M1, Wu J1, Hao J1,2, Liu W1,3, Tang Y1,4, Li X1, Su H5, Qiu W6. Selenocystine-induced cell apoptosis and S-phase arrest inhibit human triple-negative breast cancer cell proliferation. In Vitro Cell Dev Biol Anim. 2015 Nov;51(10):1077-84.
- Fan CD1, Fu XY1, Zhang ZY1, Cao MZ2, Sun JY3, Yang MF1, Fu XT1, Zhao SJ1, Shao LR1, Zhang HF1, Yang XY4, Sun BL5,6. Selenocysteine induces apoptosis in human glioma cells: evidence for TrxR1-targeted inhibition and signaling cАФКstalk. Sci Rep. 2017 Jul 25;7(1):6465. doi: 10.1038/s41598-017-06979-2.
- Weisberger AS, Suhrland LG. Studies on analogues of L-cysteine and L-cystine: III. The effect of selenium cystine on leukemia. Blood 1956;11:19–30.
- Полубояринов П.А., Дерягина В.П., Глебова Н.Н., Моисеева И.Я., Швец В.И. Токсичность L-селеноцистина и его влияние на рост перевиваемой метастазирующей карциномы легких Льюиса. Биофармацевтический журнал. 2018. Т. 10. № 3. С. 76-81.
Формы селена, обладающие противопухолевой активностью.
- Rizky A, Kaori Mi, Minato N, et al. Chemical forms of selenium for cancer prevention. J Trace ElemMed Biol 2005;19:141–50.
- Fernandes AP1, Wallenberg M, Gandin V, Misra S, Tisato F, Marzano C, Rigobello MP, Kumar S, Björnstedt M. Methylselenol formed by spontaneous methylation of selenide is a superior selenium substrate to the thioredoxin and glutaredoxin systems. PLoS One. 2012;7(11):e50727.
- Wang L, Bonorden MJ, Li GX, Lee HJ, Hu H, et al. (2009) Methyl-selenium compounds inhibit pАФКtate carcinogenesis in the transgenic adenocarcinoma of mouse pАФКtate model with survival benefit. Cancer Prev Res (Phila) 2: 484–495.
- Li GX, Hu H, Jiang C, Schuster T, Lu J (2007) Differential involvement of reactive oxygen species in apoptosis induced by two classes of selenium compounds in human pАФКtate cancer cells. Int J Cancer 120: 2034–2043.
- Stewart MS, Spallholz JE, Neldner KH, Pence BC (1999) Selenium compounds have disparate abilities to impose oxidative stress and induce apoptosis. Free Radic Biol Med 26: 42–48.
- Lanfear J, Fleming J, Wu L, Webster G, Harrison PR (1994) The seleniummetabolite selenodiglutathione induces p53 and apoptosis: relevance to the chemopreventive effects of selenium? Carcinogenesis 15: 1387–1392.
- Ip C, Thompson HJ, Zhu Z, et al. In vitro and in vivo studies of methylseleninic acid: evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention. Cancer Res. 2000;60:2882–86.
- Spallholz JE, Shriver BJ, Reid TW. Dimethyldiselenide and methylseleninic acid generate superoxide in an in vitro chemiluminescence assay in the presence of glutathione: implications for the anticarcinogenic activity of L-selenomethionine and L-Se-methylselenocysteine. Nutr Cancer. 2001;40:34–41.
- Ganther H.E.; Lawrence J.R. Chemical transformations of selenium in living organisms. Improved forms of selenium for cancer prevention // Tetrahedron. 1997. № 53. P. 12299–12310.
Метилселеноцистеин (MeSec, Se-метил-L-селеноцистеин)
- 102. Whanger PD. Selenocompounds in plants and animals and their biological significance. J Am Coll Nutr. 2002;21:223–232.
- 103. Whanger PD. Selenium and its relationship to cancer: an update dagger. Br J Nutr. 2004;91:11–28.
- Medina D, Thompson H, Ganther H, Ip C. Se-methylselenocysteine: a new compound for chemoprevention of breast cancer. Nutr Cancer. 2001;40:12–17.
- Sinha R, Medina D. Inhibition of cdk2 kinase activity by methylselenocysteine in synchronized mouse mammary epithelial tumor cells. Carcinogenesis. 1997;18:1541–1547.
- Lu J, Pei H, Ip C, Lisk DJ, Ganther H, Thompson HJ. Effect on an aqueous extract of selenium-enriched garlic on in vitro markers and in vivo efficacy in cancer prevention. Carcinogenesis. 1996;17:1903–1907.
- Dong Y, Ganther HE, Stewart C, Ip C. Identification of molecular targets associated with selenium-induced growth inhibition in human breast cells using cDNA microarrays. Cancer Res. 2002;62:708–714.
- Unni E, Singh U, Ganther HE, Sinha R. Se-methylselenocysteine activates caspase-3 in mouse mammary epithelial tumor cells in vitro. Biofactors. 2001;14:169–177.
- Ip C, Thompson HJ, Zhu Z, Ganther HE. In vitro and in vivo studies of methylseleninic acid: evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention. Cancer Res. 2000;60:2882–2886.
- Unni E, Kittrell FS, Singh U, Sinha R. Osteopontin is a potential target gene in mouse mammary cancer chemoprevention by Se-methylselenocysteine. Breast Cancer Res. 2004;6:R586–R592.
- Ip C, Dong Y. Methylselenocysteine modulates proliferation and apoptosis biomarkers in premalignant lesions of the rat mammary gland. Anticancer Res. 2001;21:863–867.
- Sinha R, Kiley SC, Lu JX, Thompson HJ, Moraes R, Jaken S, Medina D. Effects of methylselenocysteine on PKC activity, cdk2 phosphorylation and gadd gene expression in synchronized mouse mammary epithelial tumor cells. Cancer Lett. 1999;146:135–145.
Sem
- George G.N., Pickering I.J., Pushie M.J., Nienaber K., Hackett M.J., Ascone I., Hedman B., Hodgson K.O., Aitken J.B., Levina A. X-ray-induced photo-chemistry and X-ray absorption spectАФКcopy of biological samples // J. Synchrotron Radiat. 2012. № 19. P. 875–886.
- Okuno T., Kubota T., Kuroda T., Ueno H., Nakamuro K. Contribution of enzymic alpha, gamma-elimination reaction in detoxification pathway of selenomethionine in mouse liver // Toxicol. Appl. Pharmacol. 2001. № 176. P. 18–23.
- Suzuki K.T., Kurasaki K., Suzuki N. Selenocysteine beta-lyase and methylselenol demethylase in the metabolism of Se-methylated selenocompounds into selenide // Biochim. Biophys. Acta Gen. Subj. 2007. № 1770. P. 1053–1061.
- Aitken J.B., Levina A., Lay P.A. Studies on the biotransformations and biodistributions of metal-containing drugs using X-ray absorption spectАФКcopy. // Curr. Top. Med. Chem. 2011. № 11. P. 553–571.
- 117. Arup Bhattacharya. Methylselenocysteine – a Promising Antiangiogenic Agent forOvercoming Drug Delivery Barriers in Solid Malignancies forTherapeutic Synergy with Anticancer Drugs Expert Opin Drug Deliv. 2011 June ; 8(6): 749–763.
- Spallholz JE1, Shriver BJ, Reid TW. Dimethyldiselenide and methylseleninic acid generate superoxide in an in vitro chemiluminescence assay in the presence of glutathione: implications for the anticarcinogenic activity of L-selenomethionine and L-Se-methylselenocysteine. Nutr Cancer. 2001;40(1):34-41.
- Miki K, Xu M, Gupta A, et al. Methioninase cancer therapy with selenomethionine suicide prodrug substrate. Cancer Res. 2001; 61 : 6805–10.
- Miki K, Al-Refaie W, Xu M, et al. Methioninase gene therapy with recombinant methioninase treatment. Cancer Res. 2000; 60 : 2696–702.
- Gupta A, Miki K, Xu M, et al. Combination efficacy of doxorubicin and adenoviral methioninase gene therapy with prodrug selenomethionine. Anticancer Res. 2003; 23 : 1181–8.
- Yamamoto N, Gupta A, Xu M, et al. Methioninase gene therapy with selenomethionine induces apoptosis in bcl-2-overproducing lung cancer cells. Cancer Gene Ther. 2003; 10 : 445–50.
- Wang Z, Jeang C, Lu J. Induction of caspase-mediated apoptosis and cell-cycle G1 arrest by selenium metabolite methylselenol. Mol carcinog. 2002; 34 : 113–20.
- Spallholz JE, Palace VP, Reid TW. Methioninase and selenomethionine but not Semethylselenocysteine generate methyl chemical and superoxide in vitro chemiluminescent assay: implications for the nutritionalcarcinostatic activity of selenoamino acids. Biochem Pharmacol. 2004; 67 : 547–54.
- 1 Cancer Gene Ther. 2003 Jun; 10 (6): 445-50. Methioninase gene therapy with selenomethionine induces apoptosis in bcl-2-overproducing lung cancer cells. Yamamoto N 1 , Gupta A , Xu M , Miki K , Tsujimoto Y , Tsuchiya H , Tomita K , Moossa AR , Hoffman RM .
- Mol Cancer Ther. 2006 Dec; 5 (12): 3275–3284.Apoptosis induced by selenomethionine and methioninase is superoxide-mediated and p53-dependent in human pАФКtate cancer cells. Rui Zhao , Frederick E. Domann , and Weixiong Zhong
MSA
- Zhao, H.; Whitfield, M. L.; Xu, T.; Botstein, D.; Brooks, J. D. (2003). “Diverse effects of methylseleninic acid on the transcriptional program of human prostate cancer cells”. Molecular Biology of the Cell. 15: 506–519.
- Li, G. X.; Lee, H. J.; Wang, Z.; Hu, H.; Liao, J. D.; Watts, J. C.; Combs, G. F.; Jr; Lu, J. (2008). “Superior in vivo inhibitory efficacy of methylseleninic acid against human prostate cancer over selenomethionine or selenite”. Carcinogenesis. 29: 1005–1012.
- Qi, Y.; Fu, X.; Xiong, Z.; Zhang, H.; Hill, S.M.; Rowan, B.G.; Dong, Y. (2012). “Methylseleninic acid enhances paclitaxel efficacy for the treatment of triple-negative breast cancer”. PLOS ONE. 7: e31539.
- Gao, R.; Zhao, L.; Liu, X.; Rowan, B.G.; Wabitsch, M.; Edwards, D.P.; Nishi, Y.; Yanase, T.; Yu, Q.; Dong, Y. (2012). “Methylseleninic acid is a novel suppressor of aromatase expression”. J. Endocrinol. 212: 199–205.
- Yin, S; Dong, Y; Li, J; Fan, L; Wang, L; Lu, J; Vang, O; Hu, H (2012). “Methylseleninic acid potentiates multiple types of cancer cells to ABT-737-induced apoptosis by targeting Mcl-1 and Bad”. Apoptosis. 17: 388–399.
131.Wu, X.; Zhang, Y.; Pei, Z.; Chen, S.; Yang, X.; Chen, Y.; Lin, D.; Ma, R.Z. (2012). “Methylseleninic acid restricts tumor growth in nude mice model of metastatic breast cancer probably via inhibiting angiopoietin-2”. BMC Cancer. 12: 192.
- Yan, L.; DeMars, L.C. (2012). “Dietary supplementation with methylseleninic acid, but not selenomethionine, reduces spontaneous metastasis of Lewis lung carcinoma in mice”. Int. J. Cancer. 131: 1260–1266.
- Font M1, Zuazo A, Ansó E, Plano D, Sanmartín C, Palop JA, Martínez-Irujo JJ.Novel structural insights for imidoselenocarbamates with antitumoral activity related to their ability to generate methylselenol.Bioorg Med Chem. 2012 Sep 1;20(17):5110-6.
- E. Ibanez, A. Agliano, C. Prior, P. Nguewa, M. Redrado, I. Gonzalez-Zubeldia, D. Plano, J. A. Palop, C. Sanmartin, A. Calvo. The Quinoline Imidoselenocarbamate EI201 Blocks the AKT/mTOR Pathway and Targets Cancer Stem Cells Leading to a Strong Antitumor Activity. Current Medicinal Chemistry Volume 19 , Issue 18 , 2012
Эбселен
- 38. Sies H. // Free Radic. Biol. Med. 1993. V.14. № 3. P. 313–323.
- 52. Parnham M.J., Sies H. // Biochem Pharmacol. 2013. V. 86. № 9. P. 1248–1253.
- 53. Masumoto H., Hashimoto K., Nakaoka M., Hakusui H. // Relation to the antioxidant activity. 1995. V. 10. С.158–161.
138 Parnham MJ1, Sies H.The early research and development of ebselen.Biochem Pharmacol. 2013 Nov 1;86(9):1248-53.
- Liang Zhang, Liwei Zhou, Jia Du, Mengxia Li, Chengyuan Qian, Yi Cheng, Yang Peng, Jiayin Xie,* and Dong Wang* Induction of Apoptosis in Human Multiple Myeloma Cell Lines by Ebselen via Enhancing the Endogenous Reactive Oxygen Species Production Biomed Res Int. 2014 BioMed Research InternationalVolume 2014, Article ID 696107, 10 pageshttp://dx.doi.org/10.1155/2014/696107
- Honglian Shi,* Shimin Liu, Minoru Miyake, and Ke Jian Liu*Ebselen Induced C6 Glioma Cell Death in Oxygen and Glucose Deprivation. Chem Res Toxicol. 2006 May; 19(5): 655–660.
- Katarzyna B. Kaczor-Keller 1, Anna Pawlik 2, Jacek Scianowski 3 , Agata Pacuła 3,Magdalena Obieziurska 3, Fabio Marcheggiani 4, Ilenia Cirilli 4 , Luca Tiano 4 and Jedrzej Antosiewicz 1,*In Vitro Anti-Prostate Cancer Activity of Two Ebselen Analogues. Pharmaceuticals 2020, 13, 47; doi:10.3390/ph13030047
- Díaz M1,2, González R3, Plano D1,2, Palop JA1,2, Sanmartín C1,2, Encío I3.A diphenyldiselenide derivative induces autophagy via JNK in HTB-54 lung cancer cells. J Cell Mol Med. 2018 Jan;22(1):289-301.
- Ferreira LM1, Azambuja JH2, da Silveira EF3, Marcondes Sari MH4, da Cruz Weber Fulco B5, Costa Prado V5, Gelsleichter NE2, Beckenkamp LR2, da Cruz Fernandes M6, Spanevello RM3, Wink MR2, de Cassia Sant Anna Alves R6, Nogueira CW5, Braganhol E7, Cruz L8. Antitumor action of diphenyl diselenide nanocapsules: In vitro assessments and preclinical evidence in an animal model of glioblastoma multiforme. J Trace Elem Med Biol. 2019 Sep;55:180-189.
Новые генераторы селеноводорода и метилселенола.
- Древко Б.И. Патент № 2051681 РФ // Б. и. 2001. № 1.
- Полубояринов П.А., Вихрева В.А., Лещенко П.П., Ариповский А.Н., Лихачев А.Н. Образование элементарного селена при распаде молекулы селенорганического препарата дафс-25 под влиянием растущего мицелия грибов Полубояринов П.А., Вихрева В.А., Лещенко П.П., Ариповский А.Н., Лихачев А.Н. Вестник Московского университета. Серия 16: Биология. 2009. № 4. С. 33-37.
146 . Полубояринов П.А., Лещенко П.П. // Журн. аналит. химии. 2013. Т. 68. С. 1063.
- Полубояринов П.А., Лещенко П.П., Моисеева И.Я., Колесникова С.Г., Эпштейн Н.Б. Механизм реакции элиминирования селена в диацетофенонилселениде под действием восстановленного глутатиона. Полубояринов П.А., Лещенко П.П., Моисеева И.Я., Колесникова С.Г., Эпштейн Н.Б. Журнал аналитической химии. 2017. Т. 72. № 7. С. 633-638.
148 . https://hmdb.ca/system/metabolites/msds/000/032/568/original/ HMDB33910.pdf?1358893281
- Полубояринов П.А., Голубкина Н.А., Аниськов А.А., Моисеева И.Я., Глебова Н.Н., Швец В.И. Синтез и биологическая активность нового 3,3′-диметилпроизводного l-селеноцистина. Биоорганическая химия. 2019. Т. 45. № 4. С. 365-373.
- Полубояринов П.А., Аниськов А.А., Швец В.И. Синтез и аналитический контроль 2-амино-3-(метилселанил)бутановой кислоты – нового производного 3,3′-диметил-L-селеноцистина. Башкирский химический журнал. 2019. Т. 26. № 2. С. 48-54.